 產經觀察:亞瑪頓擬收購鳳陽硅谷,市場擔憂利益輸送
產經觀察:亞瑪頓擬收購鳳陽硅谷,市場擔憂利益輸送
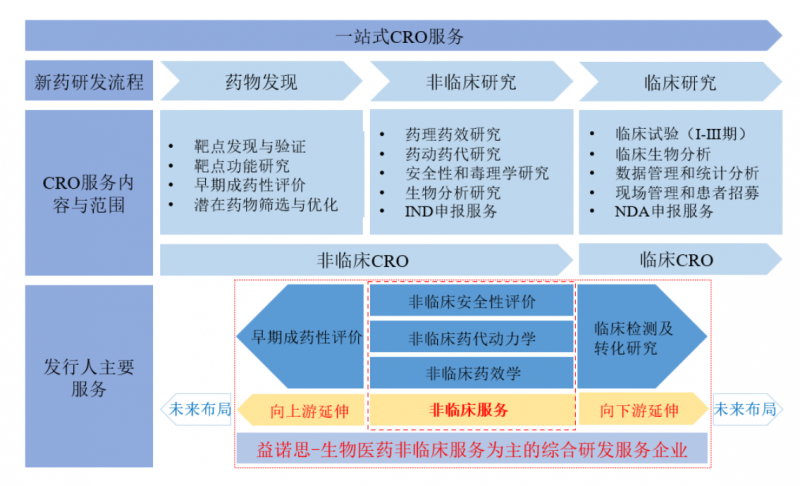
中國產經觀察消息:近期,亞瑪頓關聯并購策略受市場關注,公司擬全資收購鳳陽硅谷,后者股權變動后由林金錫家族控制。而在收購來臨之際,外部投資者撤離致凈資產縮水。此收購計劃被質疑存在利益輸送,且鳳陽硅谷業績不確定性加劇疑慮。 逾六成交易涉及實控人,風險幾何? 在光伏設備行業日益激烈的競爭格局中,常州亞瑪頓股份有限公司(簡稱“亞瑪頓”)的關聯并購策略引發了市場的廣泛關注。特別是近期該公司再度啟動對鳳陽硅谷智能有限公司(簡稱“鳳陽硅谷”)100%股權... [閱讀]
 產經觀察:僑龍應急創業板IPO前哨戰、小體量、高依賴、低研發
產經觀察:僑龍應急創業板IPO前哨戰、小體量、高依賴、低研發
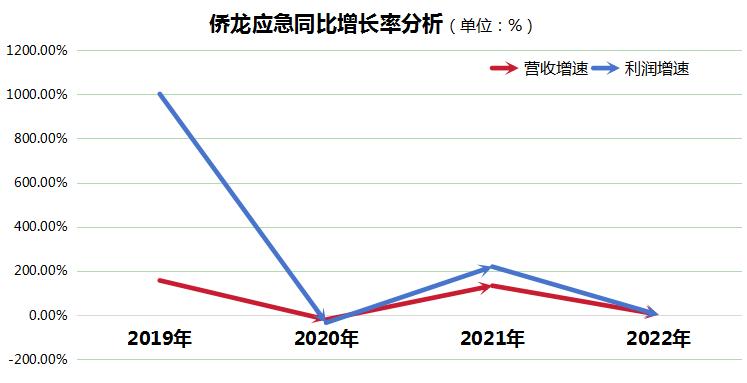
中國產經觀察消息:僑龍應急是國內較早涉足應急搶險裝備行業的福建籌備上市企業,在擬IPO過程中,并沒有公布2023年主要經營數據,引來市場關注。而在之前上市過程中,其暴露了核心產品大流量供排水搶險車占比超90%,營收波動性大且產品結構單一,研發投入有待提高等問題。 值得注意的是,僑龍應急招股書信息披露存疑,包括財務數據、注冊資本實繳情況與主要客戶數據不一致,引發監管與市場擔憂,或一定程度成為上市障礙。 經營體量較小,90%營收依賴單一產品 僑龍應急作為國內應急搶險裝備領域的先驅,... [閱讀]
 氫產業創新 德林海發布全球首創高壓AEM電解槽
氫產業創新 德林海發布全球首創高壓AEM電解槽
中國產經觀察消息:2024中國國際氣體工業博覽會暨第九屆國際氣體產業大會上,德林海(688069.SH)帶來了全球首創的1Nm3/h 22MPa AEM 電解槽,意味著公司布局零碳板塊迎來重磅成果落地。 該研究成果由公司全資子公司無錫德林海零碳科技有限公司(“下稱零碳科技”)獨立研發,系公司圍繞減碳和零碳的核心理念布局零碳板塊的重要階段性成果。零碳科技是德林海的全資子公司,自成立以來,積極布局光伏、儲能、氫能等零碳板塊業務,為客戶... [閱讀]
 產經觀察:技術持續革新,中國光伏產業發展有了“新質”動力
產經觀察:技術持續革新,中國光伏產業發展有了“新質”動力
中國產經觀察消息:2023年我國新能源汽車產銷量占全球比重超過60%,電動汽車、鋰電池、光伏產品“新三樣”出口增長近30%。 作為“新三樣”代表之一的光伏產品,2023年出口增長跑出了65.5%的加速度。在世界能源結構轉型與應對全球氣候變化的進程中,我國光伏產品憑借卓越的技術與品質,已然在國際市場上展現出強勁的競爭力,為新能源領域下一階段發展奠定了堅實的基礎。今天的中國光伏制造業,無論是光伏裝機量還是發電量,都位居世界之首,已成為新質生產力集... [閱讀]